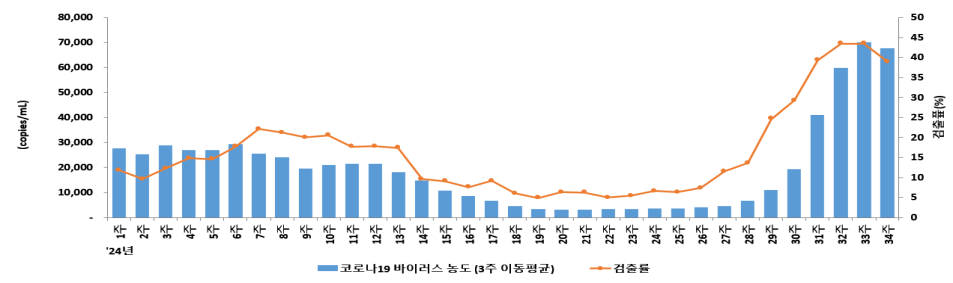
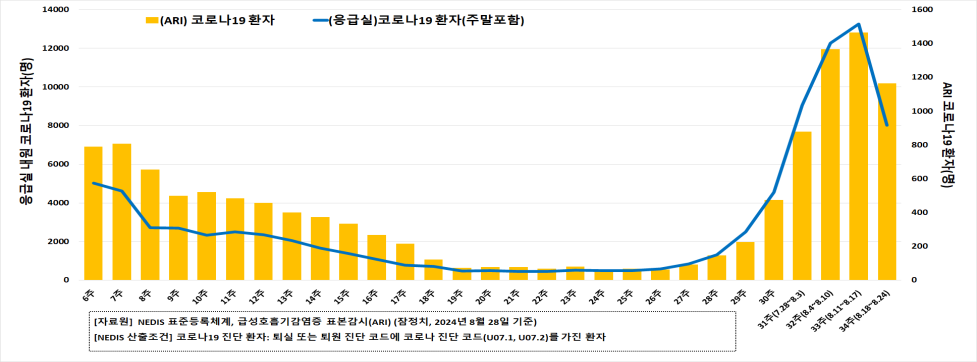
原文リンク 2024年8月30日
疾病対策庁、コロナ19 mRNAワクチン 免疫反応の調節過程を解明 |
-メッセンジャーリボ核酸(以下、mRNA)ワクチン接種部位での単一細胞転写体分析で初期免疫反応メカニズムを韓国科学技術院と共同解明 - 注入されたmRNAと脂質ナノ粒子が初期免疫を高めることでワクチンの効能増強につながる |
疾病管理庁(庁長チ・ヨンミ)国立保健研究院(院長パク・ヒョニョン)は、mRNAワクチンの接種部位で初期免疫増強効果を誘導するメカニズムを発見し、その研究結果を世界的な学術誌であるネイチャー・コミュニケーションズ(Nature Communications(IF*=14.7))ジャーナルに2024年8月27日に掲載したと発表した。
* IF (Impact factor) : 学術ジャーナルの影響力を測定する指標として、引用回数が多いほど指標が高い。
今回の研究は、国立保健研究院公共ワクチン開発支援センター感染症ワクチン研究課(課長キム・ドギュン)と韓国科学技術院のパク・ジョンウン教授の研究チームが共同で行った研究で、実験用ラット(マウス)にコロナ19 mRNAワクチンを投与した後、単一細胞転写体分析*技術を活用してmRNAワクチンの初期免疫反応を明らかにして発表したものである。
* 単細胞転写体分析:細胞一個単位で収集した転写体(遺伝子から転写されるRNAの総体)データを分析し、各細胞内の遺伝子発現度を測定できる最新の分析手法。
mRNAワクチン技術は、COVID-19のパンデミックを経験し、短期間で世界的にその価値を証明し、感染症対応だけでなく、がんワクチンのような治療戦略としても開発が活発に行われている。しかし、より安全で効果的なワクチン開発のためには、mRNAワクチンの初期免疫学的メカニズムを深く理解することが非常に重要である。
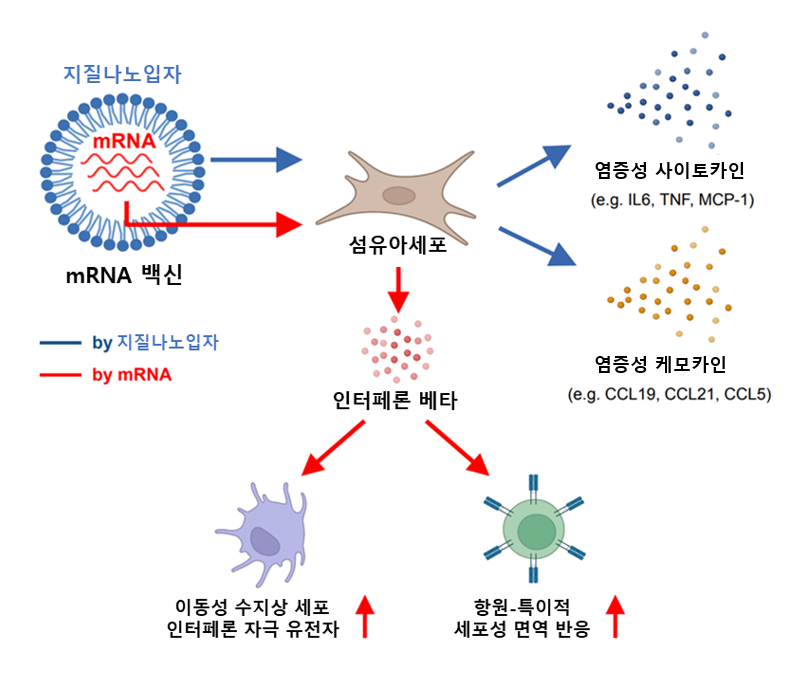
<図1.mRNAワクチン接種部位の初期免疫反応模式図(Biorender.comで製作)> |
|
図の説明: mRNAワクチンの筋肉接種時、接種部位でワクチンの構成物質である脂質ナノ粒子によって炎症性サイトカインとケモカイン(chemokine)の発現量が増加し、注入されたmRNA分子によって線維芽細胞でインターフェロンベータの発現量が増加し、移動性樹状細胞でインターフェロン刺激遺伝子の活性化を誘導し、抗原特異的細胞性免疫反応を向上させる。 |
mRNAワクチンは、mRNA分子とそれを取り巻く脂質ナノ粒子(Lipid nano particle, LNP)で構成される。mRNAは抗原タンパク質を合成できる遺伝情報を含んでおり、脂質ナノ粒子はmRNAを保護して私たちの体の細胞内に入れる移動装置の役割をする。
最近の研究によると、脂質ナノ粒子は単にmRNAの担体としての役割だけでなく、脂質ナノ粒子自体が強い免疫増強剤*(adjuvant)の役割を果たすことが報告されている。
* 免疫増強剤:ワクチンに対する免疫反応を増加させたり、調節する物質。
本研究では、マウス動物モデルにCOVID-19 mRNAワクチン接種後、注射部位の筋肉組織から細胞を分離し、接種部位で起こる脂質ナノ粒子およびmRNA分子による初期遺伝子発現の様相を単一細胞転写体分析法によって分析した。
本研究を通じて、注射部位で脂質ナノ粒子により炎症性サイトカインとケモカイン遺伝子発現が増加し、初期免疫増強効果が誘導されることを確認し、注入されたmRNA分子はインターフェロンベータ遺伝子発現を通じて接種部位及びリンパ節の移動性樹状細胞(migratory dendritic cells)の活性化を助け、ワクチンによる細胞性免疫反応を促進することが確認された。.
今回の研究は、mRNA分子と脂質ナノ粒子自体によって活性化される初期免疫反応経路および作用機序に対する洞察を得ることに貢献したという点で意義が大きい。
感染症ワクチン研究課のキム・ドグン課長は、「今後、mRNAワクチンの成分であるmRNAと脂質ナノ粒子の調節を通じて初期免疫反応を制御することで、T細胞反応を活性化させながら過剰な免疫反応を下げるmRNAワクチンを持続的に開発したい」と述べたと明らかにした。
チ・ヨンミ疾病管理庁長は、「mRNAワクチンのメカニズムに関する研究を基に、今後、mRNAプラットフォームの患者に合わせた治療薬ワクチンなど、多様な活用と効果的な次世代ワクチン技術の商用化が実現できるよう努力していきたい」と述べた。
添付 |
| 研究成果の主な内容 |
□ 論文情報
* (共同第1著者) キム・ソンリョン(韓国科学技術院), チョン・ジョンヒャン(国立保健研究院) * (共同筆頭著者) ヨ・ジンア(国立保健研究院), パク・ジョンヨン(韓国科学技術院)
□ 研究の背景と必要性 ○ 重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)は2019年末に出現し、世界的な新型コロナウイルスのパンデミックを引き起こした。 ○ mRNAワクチンはCOVID-19ワクチン開発に革命を起こし、効果的な予防剤となったが、その効能の基礎となる免疫学的メカニズムは詳しく知られていない。 ○ 本研究では、脂質ナノ粒子(LNP)またはmRNAワクチン(mRNA+LNP)接種後、単細胞転写体解析を行い、ワクチン接種部位におけるmRNAワクチンの各成分である脂質ナノ粒子およびmRNAの初期免疫反応を調査した。
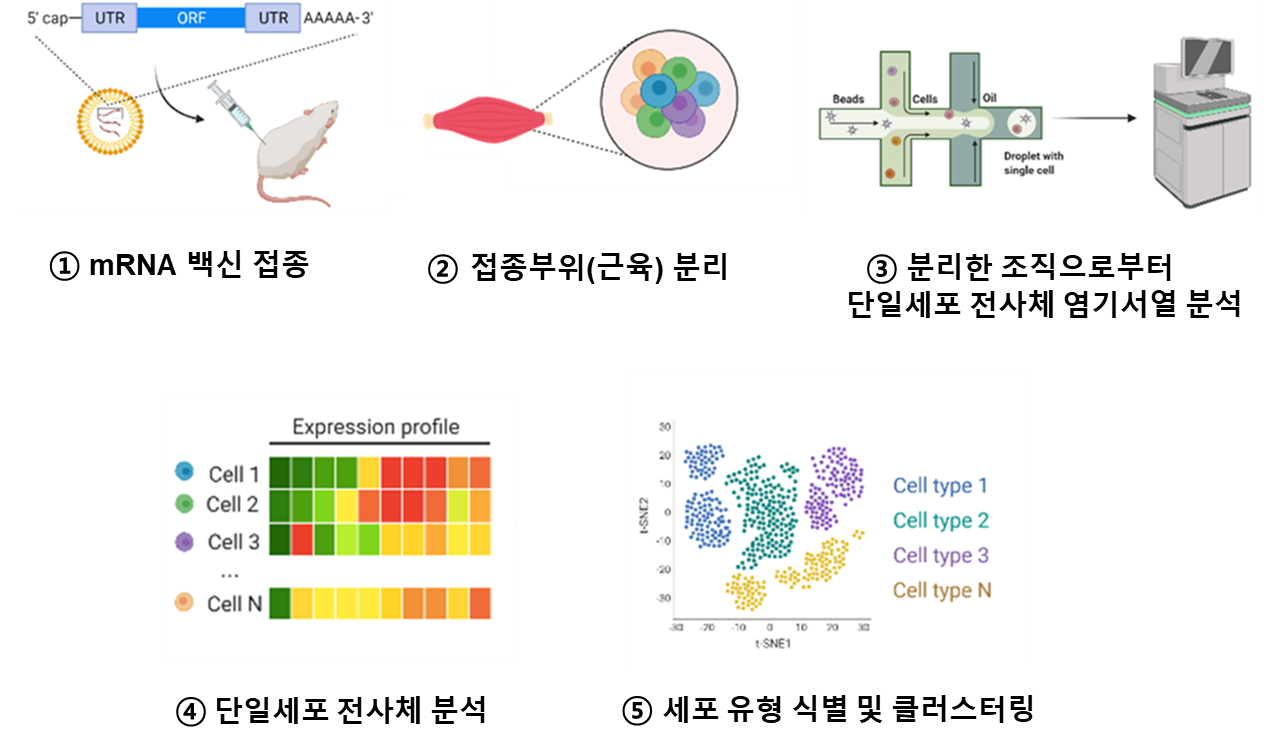
□ 研究方法 ○ COVID-19 mRNAワクチンを実験動物に筋肉接種し、複数の時点(接種後2/16/40時間)で単一細胞転写体分析(single cell RNA-sequencing)を実施。 ○ 接種部位でmRNAワクチンが投入される細胞を区別し、対照群(PBS接種群)と比較して発現量が増加する遺伝子(DEG: differential expressed gene)を細胞タイプ別に分析し、重要な遺伝子群を選別する。
<mRNAワクチン接種動物の単細胞転写体研究方法>
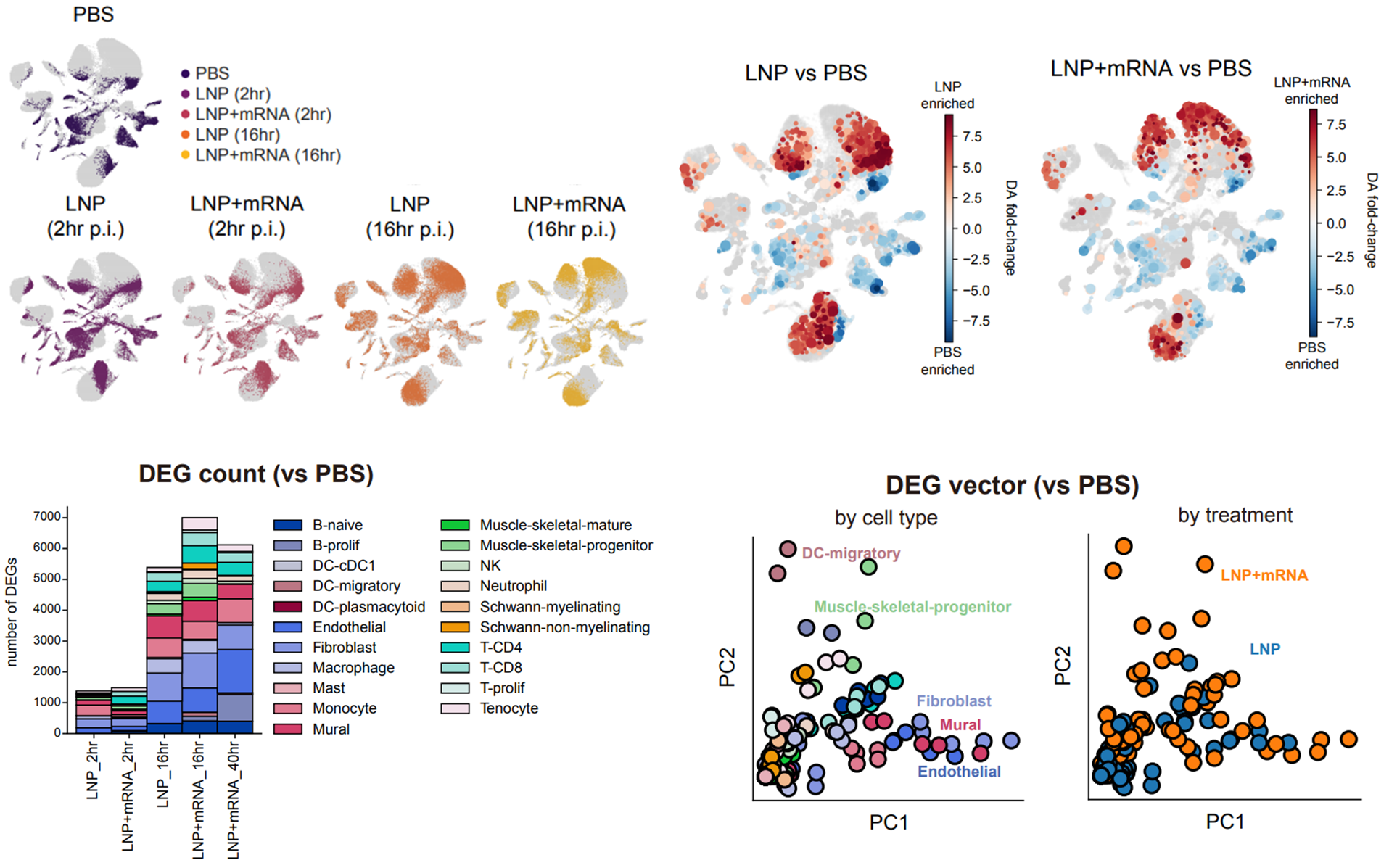
□ 研究成果 ○ mRNAワクチン筋肉接種16時間後、脂質ナノ粒子だけでも強い免疫反応が誘導され、接種部位の線維芽細胞*にmRNAワクチン投入量が著しく高くなることを確認し、それに伴いインターフェロン*ベータの発現が増加することを確認した。 * 繊維芽細胞:細胞外基質とコラーゲンを合成する細胞の一種で、動物組織の構造的骨格を生成し、動物の結合組織に重要な細胞です。 * インターフェロン:抗ウイルス性免疫物質の一つで、先天性免疫細胞(T細胞、B細胞、 (T細胞、B細胞、マクロファージなど)の活性を増加させ、免疫システムを強化する役割。
○ mRNAワクチン接種16時間後、インターフェロンベータにより、接種部位とドレインリンパ節(draining lymphnode)の移動性樹状細胞*集団において、第1型インターフェロンに関連する遺伝子発現が増加することを確認。 * 排水リンパ節:感染または注射部位から最も近いリンパ節で免疫作用をするリンパ球を作り、体を防御する役割を果たす。 * 樹状細胞:外来抗原を処理して免疫系の他の細胞のために表面に表示する抗原伝達提示細胞。
○ 転写体実験の結果から、マウスモデルにインターフェロンベータを追加または遮断した場合、それぞれワクチンによる免疫原性の向上と減少を確認し、mRNAワクチン機能に対するインターフェロンベータの免疫学的役割を初めて明らかにした。
<mRNAワクチン接種部位の単細胞転写体研究成果>
□ 結論と期待効果 ○ 今回の研究は、COVID-19 mRNAワクチン接種部位での単一細胞転写体分析を通じて、mRNAワクチンの初期免疫反応のメカニズムを明らかにした。 ○ mRNAワクチンの構成要素である脂質ナノ粒子の強い免疫増強の役割を明らかにし、接種部位の線維芽細胞にmRNAワクチンが過剰投入された後、mRNA成分によってインターフェロンベータが誘導され、T細胞の免疫活性を助けるメカニズムを新たに明らかにした。 ○ 今回の研究成果は、mRNAワクチンが引き起こす免疫反応に関連する遺伝子の機能を理解し、今後、効果的なmRNAワクチンを開発するための新たな研究方向を提示する見通しである。 |