新型コロナウイルス感染症後の 認知障害を引き起こす原因の特定 |
- 国立保健研究院、コロナ19ウイルスタンパク質が記憶力及び認知機能低下を引き起こすメカニズムを解明 - 糖尿病治療薬「メトホルミン」が神経保護効果を示し、新たな治療可能性を提示 |
疾病管理庁(庁長イム・スングァン)国立保健研究院(院長職務代理キム・ウォンホ)は、COVID-19感染後に報告される集中力・記憶力低下などの「認知障害」の原因を動物実験を通じて科学的に解明したと発表した。
[COVID-19スパイクタンパク質(S1)、脳機能を直接阻害]
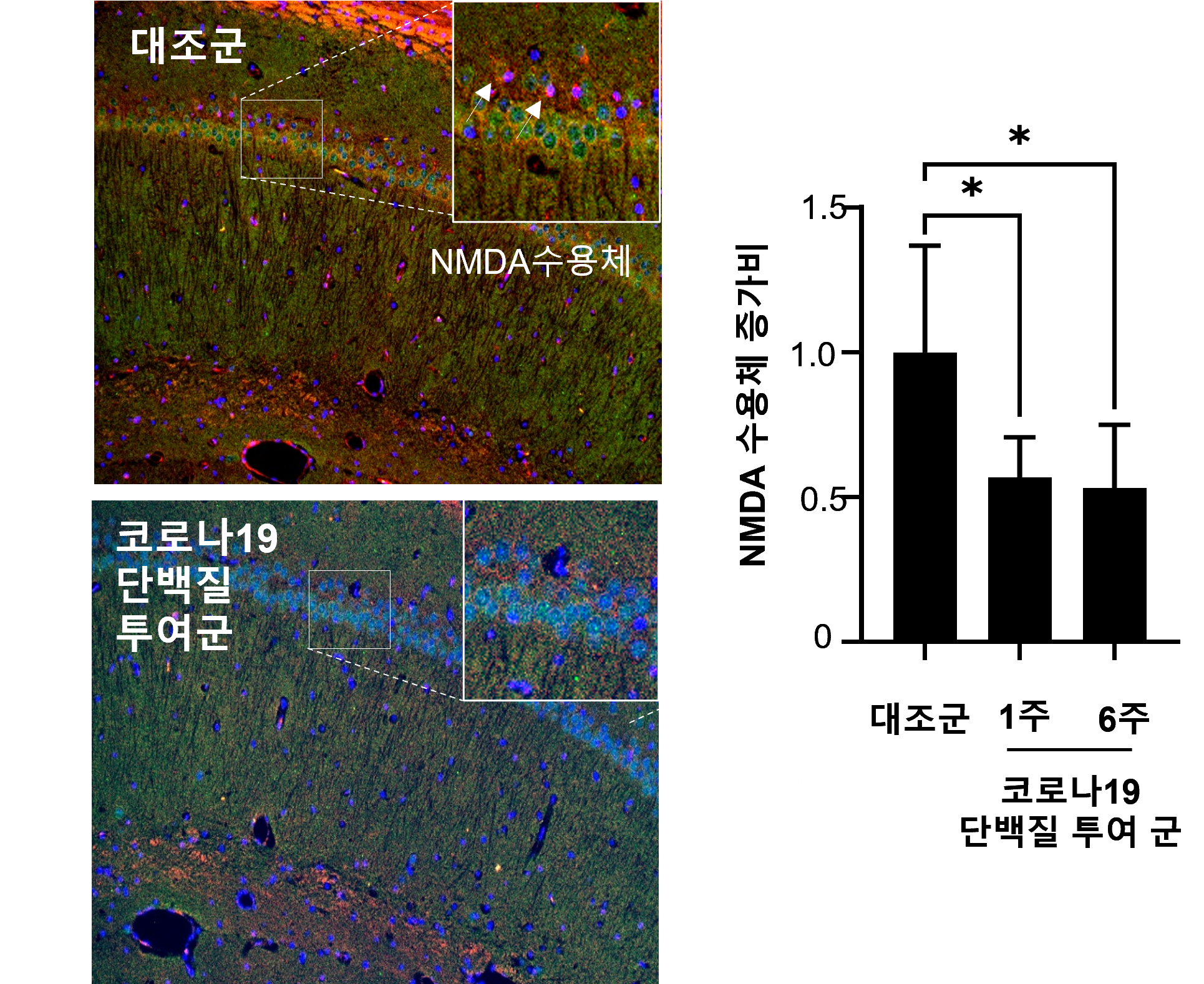
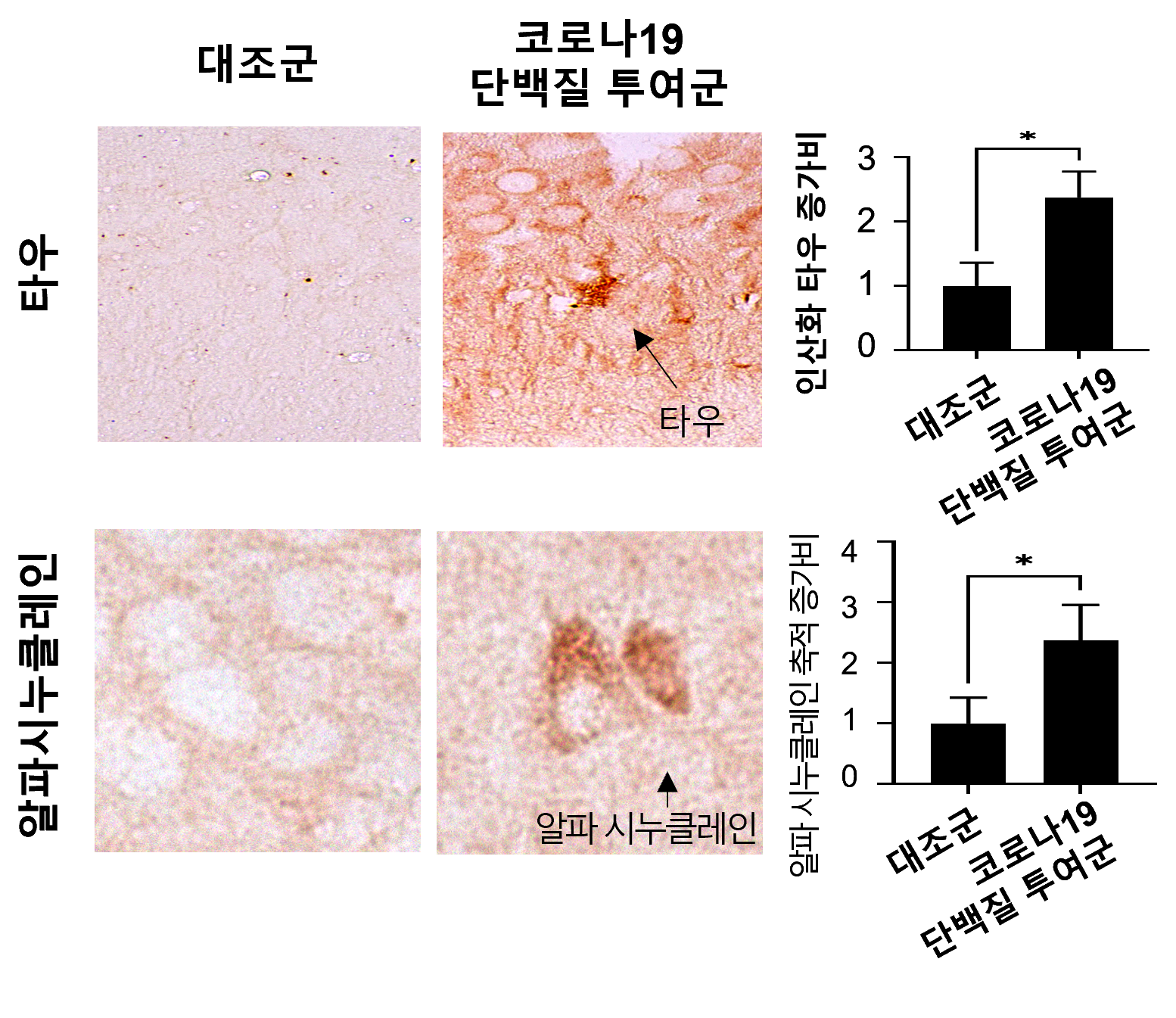
研究の結果、COVID-19ウイルスのスパイクタンパク質(S1)が脳に到達し、神経細胞間の接続(シナプス)機能を妨げ、記憶形成に重要なNMDA受容体*遺伝子の発現を減少させるとともに、認知症やパーキンソン病に関連する毒性タンパク質(タウおよびαシヌクレイン)の蓄積を増加させることが確認された。
* 脳において神経細胞間の信号伝達と記憶形成に重要な役割を果たす受容体
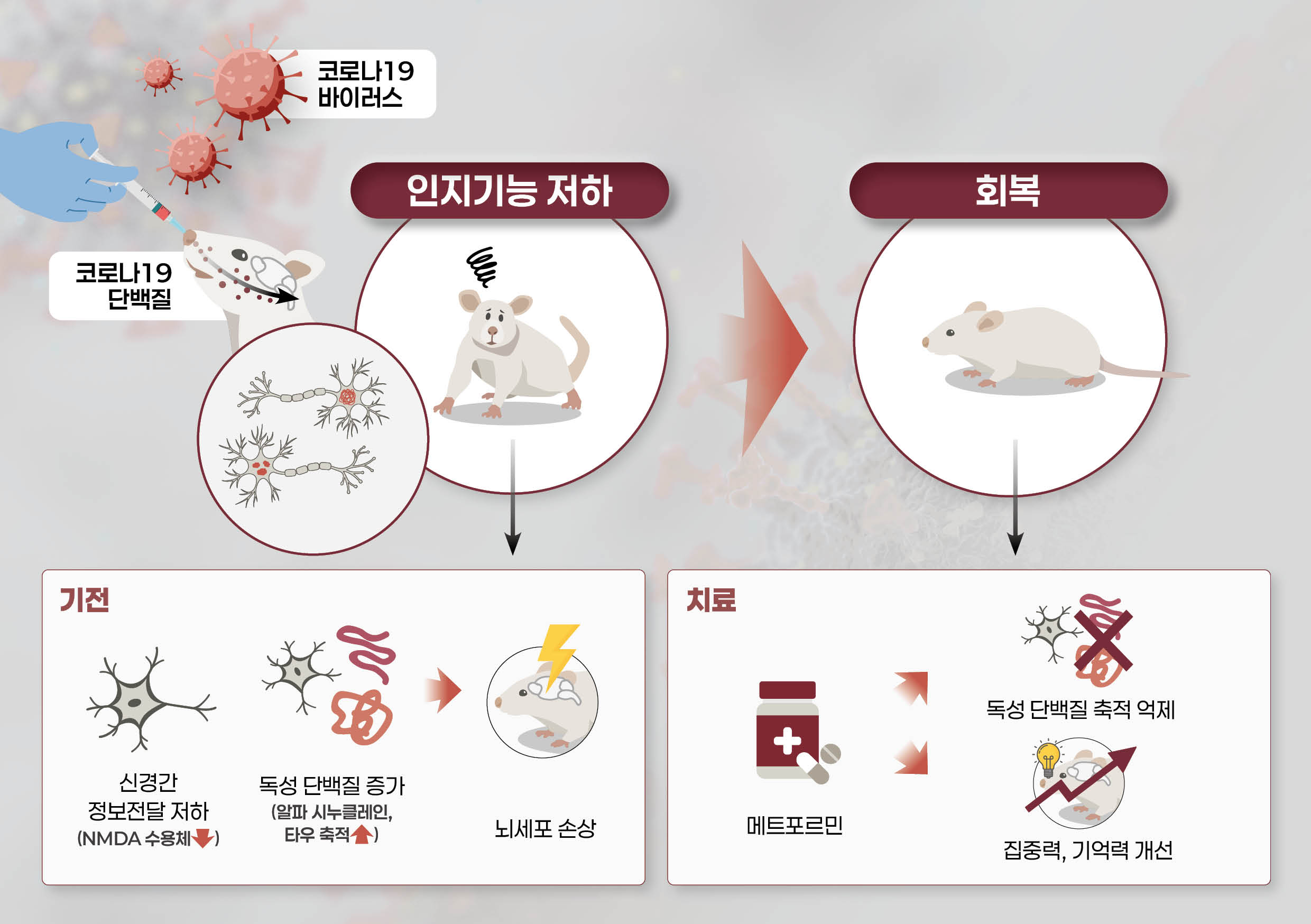
[メトホルミン、脳保護効果を確認]
研究チームは、同じ条件下で糖尿病治療薬である「メトホルミン」を併用した実験において、神経細胞機能が回復し、毒性タンパク質の蓄積が減少する効果を観察した。
「メトホルミン」はすでに広く使用されている糖尿病治療薬であり、今回の研究はCOVID-19感染後に現れる認知障害の治療可能性を示した、初めての科学的根拠という点で意義がある。
研究を主導した国立保健研究院のコ・ヨンホ博士研究チーム
(イ・ヘギョン博士:筆頭著者)は「COVID-19感染後に現れる
認知障害の病理メカニズムを解明し、実際の臨床でも広く使用されている
メトホルミンがこれを抑制できる可能性を示したことに大きな意義がある」と述べた。
したがって、「今後の臨床研究を通じて、集中力低下、記憶力低下などの、慢性COVID-19症候群(COVID-19後遺症)の治療薬としての可能性を、検討する必要がある」と述べた。
国立感染症研究所(所長職務代理 鄭永基)治療臨床研究課の金貞妍課長は 「2022年8月から『慢性COVID-19症候群調査研究事業』を通じて、国内の慢性COVID-19症候群の様相及び原因機序の解明研究とともに、治療剤発掘のための臨床試験も進めている」と明らかにし、「慢性COVID-19症候群患者の管理のための科学的根拠を整え、迅速に共有する」と述べた。
イム・スングァン疾病管理庁長官は「コロナ19後も長期にわたり症状に苦しむ患者に関する研究が必要だ」と強調し、「科学的根拠に基づく感染症政策を策定するための研究及び脳疾患研究を継続的に支援していく」と伝えた。添付 |
| 研究結果[論文] 要約 |
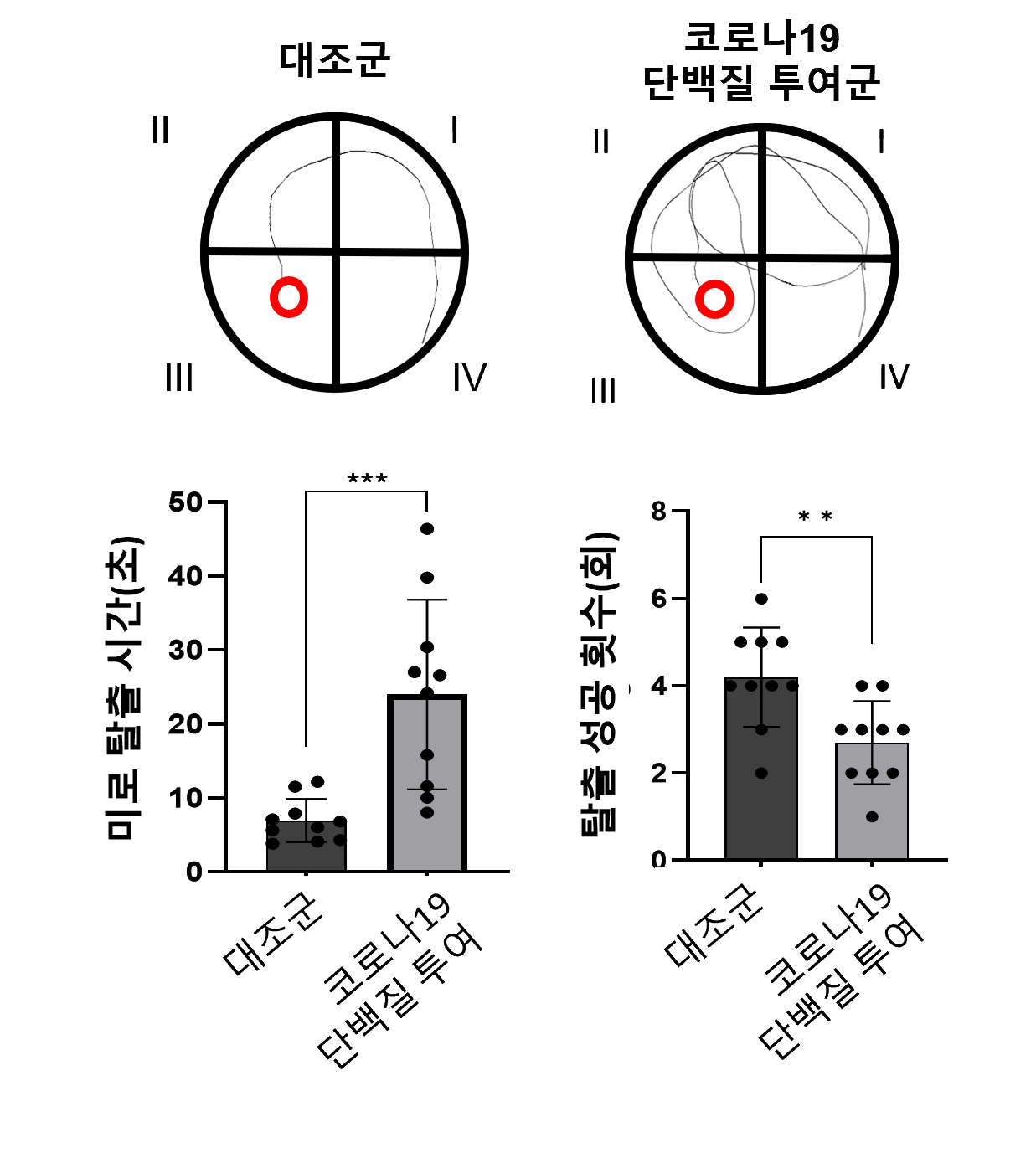
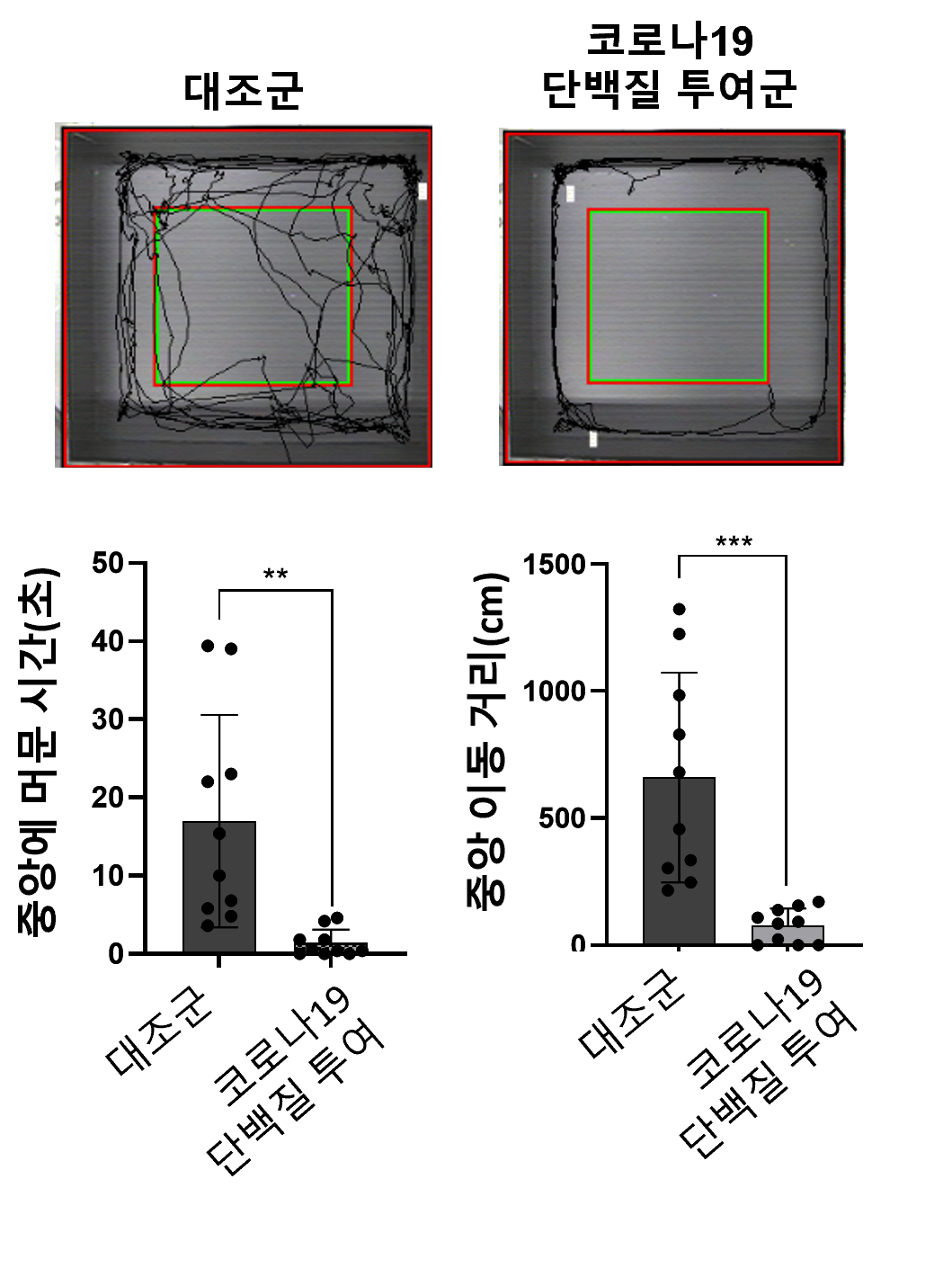
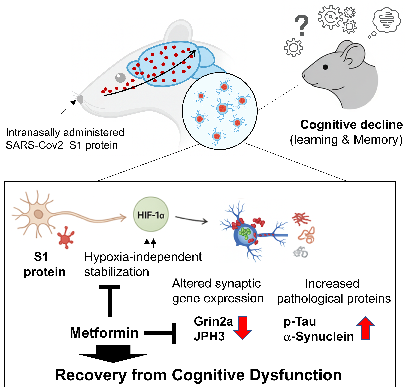
□ 掲載学術誌 : PLOS ONE (2025. 11. 7) □ 論文題目 (国文) SARS-CoV-2スパイクタンパク質がシナプス機能障害および病理タンパク質蓄積を引き起こし、認知障害を生じるメカニズムとメトホルミンの保護効果 (英文) SARS-CoV-2 spike protein causes synaptic dysfunction and p-tau and α-synuclein aggregation leading cognitive impairment: The protective role of metformin □ 研究目的 : 新型コロナウイルス感染症回復患者に報告される認知障害の分子メカニズムを解明し、糖尿病治療薬メトホルミンの神経保護効果と治療的可能性を評価することを目的とする。 □ 研究背景 全世界のCOVID-19累積感染者7億7千万人のうち、約20~30%が疲労、記憶力低下、集中力低下などの持続的な神経学的後遺症を経験している。 SARS-CoV-2ウイルスのスパイクタンパク質(S1サブユニット)は、感染後数か月以上にわたり血液および脳組織内に存在し得る。これは神経細胞機能の低下や変性変化を引き起こす可能性が指摘されてきた。しかし、S1タンパク質が直接的にシナプス機能や神経変性病理変化に及ぼす影響とその機序は、明確に解明されていない。 □ 研究方法 - 動物モデル実験:Sprague-DawleyラットにCOVID-19ウイルスタンパク質(0.5 μg)を鼻腔投与し、6週間後に行動実験(エピソード様記憶、モリス水迷路)を実施 - 転写体解析:海馬組織mRNAシーケンシングによるシナプス機能関連遺伝子の変化を解析 - 免疫組織化学およびタンパク質分析:HIF-1α、NMDAR2A、JPH3、p-tau、α-シヌクレインの発現を免疫染色とウエスタンブロットで評価 - 細胞実験:神経細胞株(N2A、H4)にCOVID-19ウイルスタンパク質およびメトホルミンを併用処理後、遺伝子およびタンパク質発現の変化を確認 □ 研究結果 - COVID-19ウイルスタンパク質(S1)の脳内侵入及び認知障害誘発:動物モデルにおいて鼻腔投与されたCOVID-19ウイルスタンパク質は3時間以内に海馬に到達し、6週間後に学習・記憶能力などの認知能力が有意に低下した
* 水中迷路試験(Water maze test): ネズミが水中にある隠されたプラットフォームを見つけるまでの時間を測定し、学習能力と記憶力を評価する検査である。迷路脱出時間が長いほど、学習および記憶力が低下していると評価できる。 ** 開放空間行動試験(Open field test): 慣れない空間での動きと滞在位置を観察し、不安レベルと探索行動を評価する検査である。開放空間の中央部に対する探索行動が少ないほど、不安レベルが高いと評価できる。 - シナプス機能低下および遺伝子発現変化:投与1週間後、シナプス可塑性に関連する遺伝子(GRIN2A、JPH3など)が顕著に減少し、記憶形成に関連するNMDA受容体が減少した。 - 長期的な神経変化:6週間後、海馬神経細胞の減少とともに、認知症・パーキンソン病関連病理タンパク質(過リン酸化タウおよび凝集したαシヌクレイン)の蓄積が観察された。
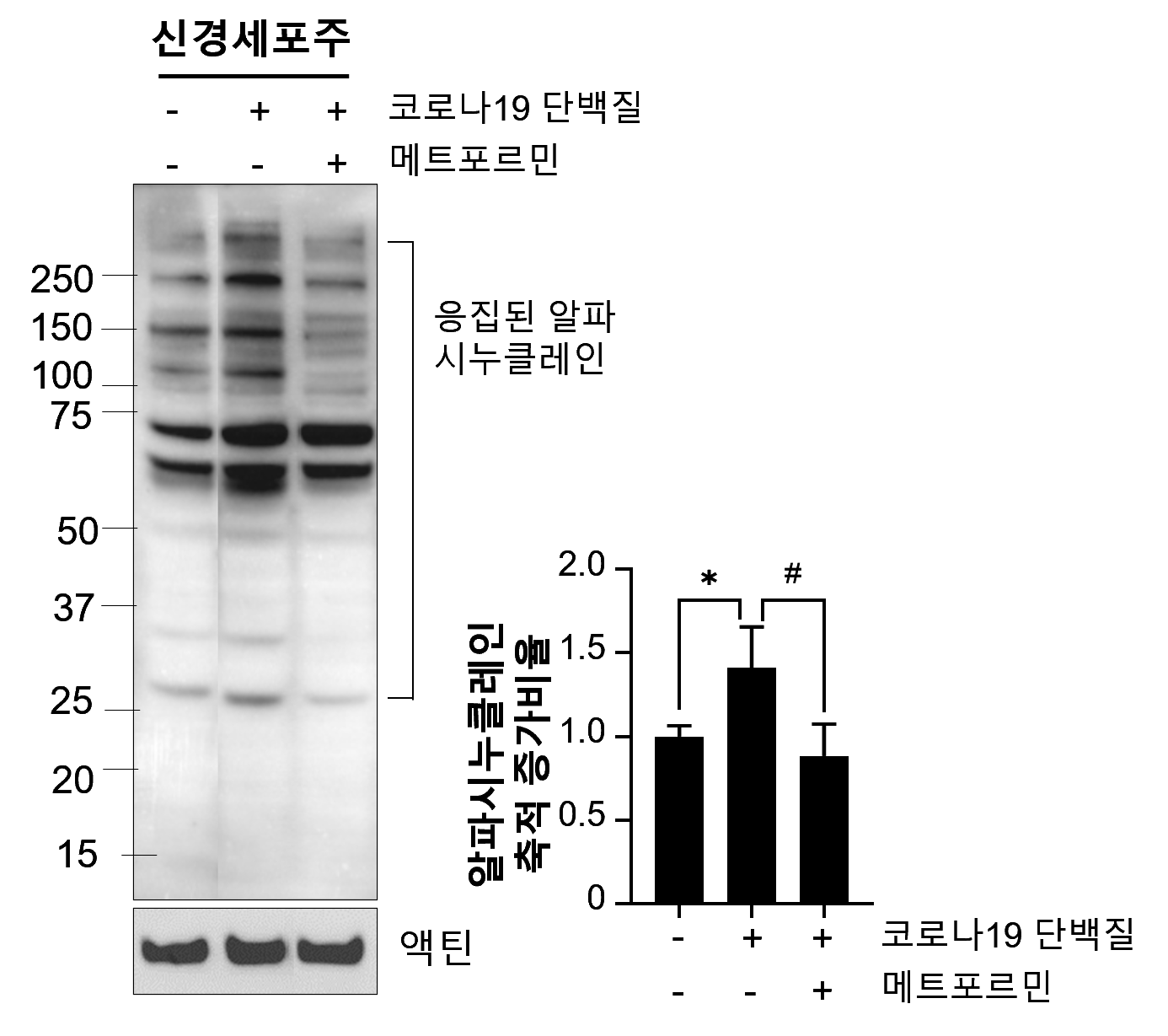
- メトホルミンの保護効果:細胞実験において、メトホルミンがCOVID-19ウイルスタンパク質による毒性タンパク質の蓄積を有意に抑制した。
□ 結論 COVID-19ウイルスタンパク質はシナプス可塑性の低下と神経変性タンパク質の蓄積を引き起こし、認知機能障害を招く。一方、メトホルミンはこうした病理的変化を抑制することで、COVID-19感染後に現れる認知障害の治療選択肢としての可能性を秘めている。
연구 내용 요약도 |

0 件のコメント:
コメントを投稿